同位素示踪检测技术与蛋白质组学结合验证谷氨酰胺氮代谢的改变促进癌症的恶性进展
葡萄糖和谷氨酰胺是支持细胞中能量产生和生物合成的两种营养物质。其中谷氨酰胺不仅提供碳,还提供氮,是合成各种化合物(如嘌呤和嘧啶核苷酸、氨基葡萄糖6-磷酸和非必需氨基酸)所必需的。谷氨酰胺也是癌症细胞生物能量和生物合成所需的重要碳源。虽然谷氨酰胺分别与谷氨酰胺酶(GLS1)和5-磷酸核糖焦磷酸(PPAT)直接发生分解代谢和合成代谢反应,但谷氨酰胺与肿瘤恶性程度之间的关系仍未完全阐明。为了解谷氨酰胺与肿瘤之间的关系,日本九州大学Keiichi I. Nakayama团队利用靶向蛋白质组学(iMPAQT)与代谢组学分析结合稳定同位素标记谷氨酰胺检测小细胞肺癌(SCLC)等癌症代谢全貌,相关成果发表于《Nature Communications》。
蛋白质组和代谢组学变化的整体视角
这项研究的概况如图1a所示。为了用iMPAQT系统描述癌症恶性进展过程中代谢变化的整体情况,研究团队首先建立了一个恶性转化模型,用编码人端粒酶催化成分(hTERT)和c-Myc的逆转录病毒感染正常人二倍体成纤维细胞(TIG-3),将在三维(3-D)培养基中生长的TSM克隆在2-D培养基中扩增以获得AIG(锚定非依赖性生长)-1、AIG-2和AIG-3细胞,TSM到AIG-3的恶性进展与c-Myc表达增加有关(图1e-f)。

将iMPAQT系统应用于TSM以及AIG-1、-2和-3克隆,以综合测定342种代谢酶的丰度。与TSM细胞相比,AIG-3细胞中某些糖酵解酶的数量增加,包括己糖激酶2(HK2)、烯醇化酶1(ENO1)和乳酸脱氢酶A(LDHA),葡萄糖摄取量也增加(图2a)。这些结果表明,Warburg效应在AIG-3细胞中比在TSM细胞中更为明显。基因本体(GO)富集分析表明,与TSM细胞相比,AIG-3细胞中受影响最大的生物学过程是核酸生物合成。因此,与TSM细胞相比,AIG-3细胞中核苷酸生物合成途径(从头合成和回补途径)中的大多数酶,包括代谢谷氨酰胺的PPAT的含量都协同增加,而谷氨酰胺逆转途径的限速酶GLS1的表达在AIG-3细胞中下调(图2c,d)。为了证实在蛋白质组水平上观察到的这些葡萄糖代谢的变化,用[13C6]葡萄糖(图2e)进行了大量的同位素分析,发现AIG-3细胞的13C标记效率和柠檬酸、天冬氨酸和谷氨酸的代谢物池大小都明显高于TSM细胞(图2f-h)。
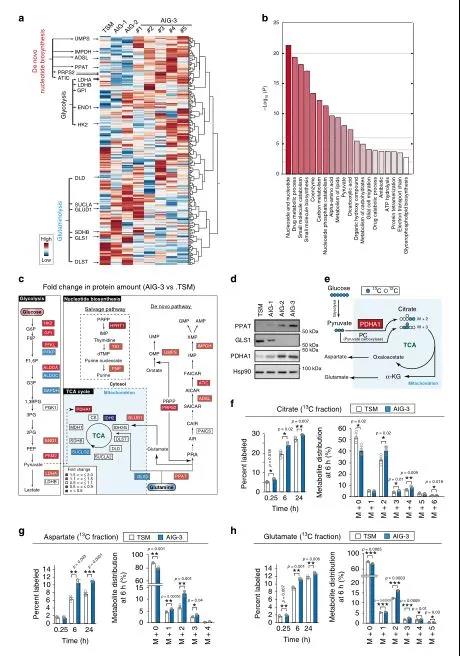
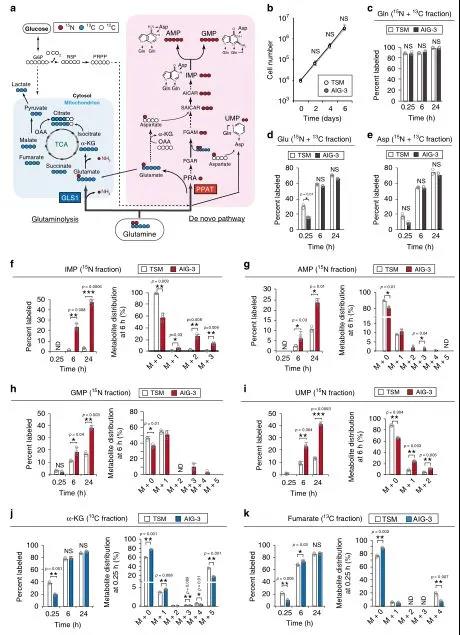
为了证实在蛋白质组水平上观察到的谷氨酰胺代谢的变化,用[13C5/15N2]谷氨酰胺以及TSM和AIG-3细胞进行了大量的同位素分析(图3a),随后评估了每个反应在标记开始后的早期(0.25小时)和后期(6小时和24小时)的标记效率。虽然在TSM或AIG-3细胞中没有检测到IMP、AMP、GMP或UMP的13C组分,但在标记开始后的6和24小时,AIG-3细胞中15N进入核苷酸生物合成途径的IMP(图3f)、AMP(图3g)、GMP(图3h)和UMP(图3i)的掺入量都显著高于TSM细胞。在AIG-3细胞中,IMP对氮的标记效率不仅在M+1和M+2组分增加,而且在M+3组分也有同样效果(图3f),这表明来自[15N]谷氨酰胺的[15N]天冬氨酸也参与了这种标记(图3e)。
在含有人体血浆生理浓度氨基酸的培养基中培养5天后,用0.6 mM [13C5/15N2]谷氨酰胺标记TSM和AIG-3细胞,AIG-3细胞对AMP和GMP的15N标记效率显著高于TSM细胞。在标记后0.25h基本上未检测到15N核酸代谢物,这表明在早期由GLS1介导的谷氨酰胺回补反应主要负责α-KG和富马酸的产生。标记6h或24h后两种细胞中α-KG和富马酸盐的13C标记效率没有差异(图3j-k),表明在该时间点这些代谢物反映了源自GLS1和PPAT依赖途径的总和。与TSM细胞相比,AIG-3细胞在0.25h时α-KG和富马酸标记效率显著降低(图3j-k),表明AIG-3细胞中GLS1活性降低。综上,蛋白质组学和代谢组学数据一致表明,在实验癌细胞模型恶性转化过程中,谷氨酰胺的命运基本上从TCA循环转移到核苷酸生物合成途径。
PPAT-GLS1平衡决定谷氨酰胺的命运
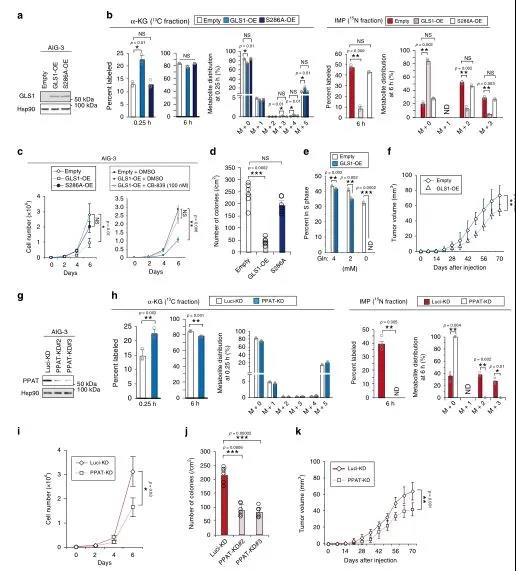
在恶性转化过程中,PPAT和GLS1的表达分别升高和降低,导致PPAT/GLS1比值升高。为了研究这两种酶之间的平衡对细胞增殖是否具有确定性,研究了GLS1在AIG-3细胞中过表达的影响(图4a)。以缺乏酶活性的突变型(S286A)的GLS1作为对照,在[13C5/15N2]中,强制表达GLS1导致α-KG标记率增加,而IMP(图4b)、AMP、GMP、谷氨酸和天冬氨酸标记率降低。AIG-3细胞在2-D(图4c)或3-D(图4d)培养基中的增殖速率也由于GLS1过表达而显著降低。且用GLS1抑制剂CB-839处理可逆转GLS1过表达并抑制AIG-3细胞增殖(图4c)。总的来说,GLS1的过度活化会抑制肿瘤生长。另外,分析了短发夹RNA(shRNA)介导的RNA干扰对AIG-3细胞PPAT耗竭的影响(图4g),通过实验证明PPAT活性降低会抑制肿瘤生长,GLS1和PPAT之间的平衡控制着谷氨酰胺衍生的碳和氮代谢从而调控细胞增殖和肿瘤生长。
PPAT作为治疗小细胞肺癌的新靶点
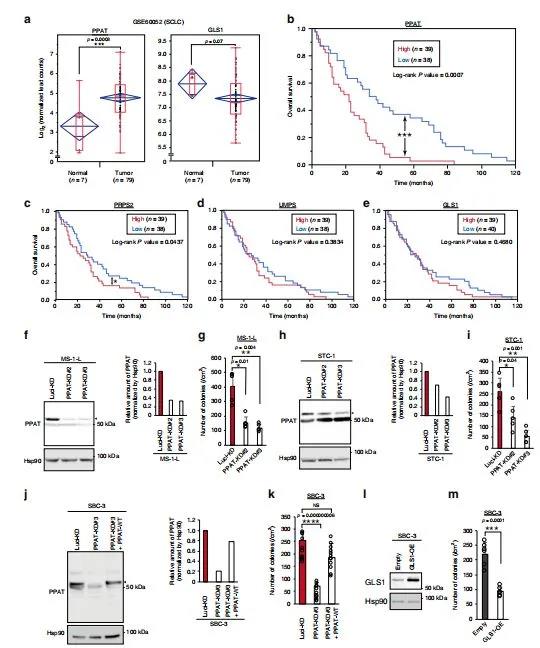
通过观察发现PPAT的表达与神经内分泌癌的不良预后显著相关,因此研究调查了这种表达是否也与小细胞肺癌(SCLC)的预后有关。小细胞肺癌患者的RNA测序数据显示,PPAT在肿瘤中的表达高于正常组织,而GLS1在肿瘤中的表达低于正常组织(图5a),PPAT高表达的个体的预后明显差于低表达的个体(图5b),作为嘧啶合成限速酶的UMP合成酶(UMPS)(图5d)和GLS1(图5e)的表达似乎都与小细胞肺癌患者的预后无关。
PPAT的缺失抑制了所有三种细胞系的锚定依赖性生长(图5f-k),而在SBC-3细胞中,这种作用被PPAT以一种抵抗shRNA介导的击倒的方式强制表达而逆转(图5j,k)。GLS1的过表达也抑制了SBC-3细胞的非锚定生长(图5l,m)。总之,PPAT的表达与小细胞肺癌患者的不良预后密切相关,并且PPAT的缺失抑制了SCLC细胞系的贴壁性生长,揭示PPAT可能是小细胞肺癌的一个有前途的治疗靶点。
该研究确定了控制谷氨酰胺代谢命运的关键因素,以及不同器官肿瘤对这些因素的依赖性。该发现为探索不同的癌症治疗方案提供了基础。
文章来源:网络
- 上一篇:各类稳定同位素的标准值
- 下一篇:震惊!!!葡萄酒里竟然有氮气






